连系新冠病毒与Ralph S. Baric的双纽带(下)
| BY: 苦难与荣耀 |
(下) 6park.com
接续:连系新冠病毒与Ralph S. Baric的双纽带(中)
https://club.6parkbbs.com/chan2/index.php?app=forum&act=threadview&tid=13523485 6park.com
新冠病毒决定ACE2结合能力,决定细胞进入(感染)能力,决定宿主范围的五个RBD关键氨基酸是人为设计的,有人参照WIV1病毒的关键氨基酸,通过氨基酸重用和等价、等效替代,设计出了新冠病毒的关键氨基酸。人为设计的新冠病毒的关键氨基酸,与WIV1(rs3367)病毒的关键氨基酸高度等价、等效(三个相同,一个高度等价,整体应该高度同构,与ACE2结合高度等效),这两个病毒关键氨基酸的高度关联,高度等价、等效性是以下三项“巧合”的内在原因:
1)新冠病毒、WIV1(rs3367)病毒的跨物种感染能力都极为强大,难分伯仲。
2)新冠病毒、WIV1(rs3367)病毒的宿主范围都极为广泛,而且,它们的宿主范围高度雷同,或者说,它们能感染的物种高度重合。
3)新冠病毒、WIV1(rs3367)病毒的刺突蛋白都极为适宜结合hACE2(human ACE2),它们的刺突蛋白与hACE2的结合亲和力都极为强大。 6park.com
本系列上篇文章已经详细介绍、说明了“巧合”1)、2),第3)项“巧合”的依据如下:
a)本系列中篇文章中的论文A-2(Ralph S. Baric团队2016年3月14日的PNAS论文)以小鼠体内实验证明:WIV1病毒刺突蛋白与hACE2的结合亲和力远强于它与mACE2的结合亲和力,WIV1-CoV(WIV1的实验室克隆)及WIV1-MA15(刺突蛋白来自WIV1的实验室嵌合病毒)两种病毒在表达hACE2的转基因小鼠(mACE2转基因为hACE2的小鼠)肺中的复制滴度,比它们在普通小鼠肺中的复制滴度高100倍!这两种病毒只能使普通小鼠出现轻微临床症状,但它们能使表达hACE2的转基因小鼠体重减轻超过10%;它们在转基因小鼠大脑中的复制比在肺中更强劲,使部分转基因小鼠患上了致命性脑炎。相关内容可参见中篇文章论文A-2要点7)。 6park.com
b)澳大利亚弗林德斯大学的论文:新冠刺突蛋白与ACE2结合亲和力的跨物种模拟比较及其对病毒起源的指示(2020年5月13日发表于预印本平台arxiv,2021年6月24日正式发表于Nature Science),通过分子动力学定量模拟研究,计算出了新冠S蛋白(刺突蛋白)与各物种ACE2相互作用的结合能(binding energies for the interactions),各物种ACE2与新冠S蛋白的结合能从高到低依次为:人类 > 穿山甲 > 狗 > 猴子 > 仓鼠 > 雪貂 > 猫 > 老虎 > 蝙蝠 > 麝猫 > 马 > 牛 > 蛇 > 老鼠。定量模拟计算结果表明:在14个对照研究物种中,与新冠病毒刺突蛋白结合能力最强的物种ACE2,是hACE2!
https://www.nature.com/articles/s41598-021-92388-5 6park.com
其实还有第四项“巧合”:新冠病毒、WIV1病毒都具有泛组织、器官感染能力。这当然首先与ACE2的泛组织、器官存在性有关;它应该同时与新冠RBD关键氨基酸的人为设计有关,因为这一人为设计赋予了新冠病毒强大的hACE2结合能力,使它能够非常有力、高效地结合人体各个组织、器官细胞的跨膜糖蛋白受体--ACE2,非常有力、高效地感染人体各个组织、器官(的细胞)。 6park.com
是谁参照WIV1(rs3367)病毒的关键氨基酸,通过复用和等价、等效替代,设计出了新冠病毒的关键氨基酸? 6park.com
设计出新冠病毒关键氨基酸的人,肯定对WIV1(rs3367)病毒,对关键氨基酸,都做过深入研究。 6park.com
有一个病毒学家,及他领导的科学团队,不仅对WIV1(rs3367)病毒、对冠状病毒的RBD关键氨基酸都做过深入的研究,而且,还同时满足以下五个条件:
1)反复、深入研究过WIV1(rs3367)病毒;
2)“无数次”研究过冠状病毒的RBD(Receptor Binding Domain,受体结合域)、RBD的关键氨基酸,对它们与ACE2,特别是与hACE2的作用机制了如指掌;
3)有着长期的,极其丰富的冠状病毒改造、合成经验,功能增益研究经验,无数次人工合成自然冠状病毒(克隆)、常规改造冠状病毒、功能增益性改造冠状病毒;
4)多次实施RBD关键氨基酸的改造、替代实验,研究它们的改变对物种感染能力,包括对人体细胞感染能力的影响,改造、培育出过多种可跨物种传播的冠状病毒,如可感染人类和灵长类动物的冠状病毒;
5)曾以WIV1(rs3367)病毒为原材料进行功能增益性的冠状病毒嵌合实验,改造出了有人类致病能力的危险病毒WIV1-MA15。 6park.com
这个病毒学家是谁?就是冠状病毒研究的全球顶级权威Ralph S. Baric。Ralph S. Baric及其团队应该是唯一全部符合以上五个条件的个人、团队。 6park.com
Ralph S. Baric以模拟、预测病毒自然突变的名义对冠状病毒进行功能增益研究,其众多论文的实质就是在探索、尝试:
如何将不能感染人类的动物来源的冠状病毒改造为可感染人类的冠状病毒,
如何将没有人类致病力的动物来源的冠状病毒改造为可使人类致病的冠状病毒,
如何增强、完善实验室冠状病毒对人类及其它动物的感染、致病能力。 6park.com
Ralph S. Baric(团队)对关键氨基酸的研究 6park.com
Ralph S. Baric团队不仅对双纽带之一--WIV1(rs3367)做过反复、深入的研究(中篇文章已经介绍了Ralph S. Baric团队研究WIV1、rs3367的四篇论文),而且对另一纽带--冠状病毒的RBD关键氨基酸也做过极其频繁、极其细致、极其深入、极其透彻的研究。 6park.com
Ralph S. Baric几乎每一篇论文都要研究冠状病毒的刺突蛋白,研究刺突蛋白的RBD,其研究RBD关键氨基酸的论文非常之多,本文将提供四篇示例。其中,论文B-1、B-2就是中篇文章中的论文A-1、A-2,Ralph S. Baric团队在这二篇论文中同时研究了WIV1病毒和冠状病毒的RBD关键氨基酸。 6park.com
论文B-1 6park.com
2015年11月9日,Ralph S. Baric团队在《自然医学》(Nature Medicine)杂志发表了著名的嵌合病毒论文:A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence(一个类似SARS的蝙蝠冠状病毒群显示了产生人类流行疫情的潜力)
https://www.nature.com/articles/nm.3985 6park.com
该论文就是中篇文章中的论文A-1。WIV1在这篇论文中是病毒主角SHC014的对照病毒。 6park.com
论文分别比较了WIV1与SARS,SHC014与SARS两对病毒RBD关键氨基酸的异同。论文指出:在刺突蛋白决定ACE2结合能力、细胞进入能力及宿主范围的5个RBD关键氨基酸(残基)中,WIV1病毒与SARS病毒虽然有三个关键氨基酸(1、2、4)不同,但其刺突蛋白仍能与hACE2(human ACE2)有效结合。 6park.com
WIV1、SARS关键氨基酸对照表。二者的第3、5关键氨基酸相同,第1、2、4关键氨基酸不同。
WIV1是具有人体细胞进入(感染)能力的特殊蝙蝠冠状病毒,其刺突蛋白可有效结合hACE2,这是石正丽团队2013年10月30日的nature论文已得出的结论,前面的描述引用了这一结论。
https://www.nature.com/articles/nature12711 6park.com
论文接着指出,相比WIV1,SHC014与SARS关键氨基酸差异更大,二者的关键氨基酸无一相同。 6park.com

SHC014、SARS关键氨基酸对照表,它们的5个关键氨基酸无一相同。
SHC014的RBD关键氨基酸与SARS迥异,它的刺突蛋白能否如SARS的刺突蛋白那样,有效结合hACE2呢?它能否如SARS那样,进入(感染)人体细胞呢?这是该论文要研究的核心问题之一(hACE2结合能力与人体细胞进入能力是等价的)。 6park.com
为解决上述问题,Baric团队用SHC014的刺突蛋白和SARS-CoV-MA15的骨架构建了嵌合病毒SHC014-MA15,并实施了该病毒对人气道上皮的感染实验。实验结果表明,SHC014-MA15能有效感染人气道上皮组织,并在组织细胞内大量复制。这即是证明了:SHC014的刺突蛋白也能有效结合hACE2,SHC014与WIV1一样,也是具有人体细胞进入(感染)能力的特殊蝙蝠冠状病毒。 6park.com
注:WIV1、SHC014都有人体细胞进入(感染)能力,同时又都没有人体致病能力,他们都不会使人体产生疾病症状;绝大多数蝙蝠冠状病毒都没有人体细胞进入(感染)能力,因而没有人体致病能力。
所有已知的蝙蝠冠状病毒,无论是否有人体细胞进入(感染)能力,它们统统都没有人体致病能力,不存在已知的有人体致病能力的蝙蝠冠状病毒(发现自蝙蝠的冠状病毒)! 6park.com
论文B-2 6park.com
2016年3月14日,Ralph S. Baric团队在PNAS(美国国家科学院院刊)发表了如下论文:SARS-like WIV1-CoV poised for human emergence(类SARS冠状病毒WIV1-CoV对人类有潜在威胁)
https://www.pnas.org/content/113/11/3048 6park.com
该论文就是中篇文章中的论文A-2。在这篇论文中,Ralph S. Baric团队对比了SARS-WT(即SARS-CoV)、SARS-MA15、WIV1三种冠状病毒与hACE2直接相互作用的14个RBD氨基酸残基,包括五个关键氨基酸残基,见图A;同时深入、细致地对照研究了SARS-CoV、WIV1这两种病毒的刺突蛋白与hACE2的接触、结合模型,特别是442、472、487三个RBD关键氨基酸残基与hACE2的作用情况,见图B。 6park.com
为便于大家理解,我对图A、图B再作一些补充说明。 6park.com
SARS-WT,SARS-CoV wild type,指SARS病毒的野生毒株;SARS-MA15,即SARS-CoV-MA15,Ralph S. Baric团队在实验室中培育的SARS-CoV的小鼠适应性变异体,SARS-CoV能感染小鼠细胞,但不会使小鼠产生临床症状,SARS-CoV-MA15则可使小鼠严重致病并致死。 6park.com
图A是SARS-WT、SARS-MA15、WIV1-CoV三种病毒刺突蛋白RBD与hACE2直接接触的14个氨基酸残基,后二种病毒与SARS-WT不同的氨基酸残基分别以深红或深蓝背景色突出显示,紫红色长条框标出了它们的5个RBD关键氨基酸残基。 6park.com
SARS病毒的五个关键氨基酸(残基)依次是刺突蛋白的第442、472、479、487、491氨基酸(残基),
WIV1病毒的五个关键氨基酸(残基)依次是刺突蛋白的第443、473、480、488、492氨基酸(残基)。 6park.com

WIV1、SARS关键氨基酸对照表
图A中14个氨基酸的序号基于SARS,WIV1的氨基酸都向前移了一位,以与SARS的对应氨基酸对齐。 6park.com
图B左图是SARS病毒刺突蛋白S1亚基(也叫受体结合亚基,S1亚基前端为RBD)与hACE2的作用模型,图B右图是WIV1病毒刺突蛋白S1亚基与hACE2的作用模型。
图B两子图中,右侧的双螺旋结构是hACE2,其上的橙黄色部分是hACE2自身的接触残基;
图B两子图中,左侧是两种病毒刺突蛋白的S1亚基,SARS的S1亚基以灰黑色表示,WIV1的S1亚基以蓝色表示。红色图案代表两病毒相同的RBD氨基酸接触残基,圆圈处是二者三个不同的关键氨基酸残基(442、472、487)与hACE2残基的作用情况。 6park.com
论文B-3 6park.com
2007年12月19日,Ralph S. Baric团队于Journal of Virology(病毒学杂志)在线发表了一篇论文:Mechanisms of Zoonotic Severe Acute Respiratory Syndrome Coronavirus Host Range Expansion in Human Airway Epithelium(人畜共患SARS冠状病毒在人气道上皮中扩大宿主范围的机制)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2258931/
https://journals.asm.org/doi/10.1128/JVI.02041-07 6park.com

Ralph S. Baric仍是论文的通讯作者。 6park.com
这篇论文主要做了以下几件事:
1)人为替换、改变了冠状病毒的RBD关键氨基酸; 6park.com
2)在人气道上皮组织中培养冠状病毒对人体细胞的适应感染能力,促使其进一步变异,并持续传代、优化、筛选新病毒; 6park.com
3)以不能感染人类的动物来源的冠状病毒为原材料,改造、培育出了两种可感染人气道上皮细胞和灵长类动物细胞,可跨物种感染、传播的冠状病毒。 6park.com
4)进行多种病毒对多种细胞的感染、复制对照实验; 6park.com
5)极为深入地研究、解读了关键氨基酸与hACE2的作用机制,以及关键氨基酸替代、改变对ACE2结合能力、细胞感染能力的影响机理。
论文病毒改造的原材料是果子狸(civet,有时译作麝香猫)类SARS冠状病毒SZ16(SARS-CoV SZ16),该病毒分离自SARS疫情期间中国广东地区动物市场中的果子狸。SZ16的刺突蛋白与SARS流行病毒株SARS-Urbani的刺突蛋白有18个氨基酸差异,其中16个位于S1亚基(S1亚基是受体结合亚基,S2亚基是膜融合亚基,受体结合域RBD是S1亚基的一部分)。 6park.com
论文列出了SZ16、SARS-Urbani、SARS-GD03三种病毒株刺突蛋白的氨基酸差异,见下图: 6park.com
蓝色表示动物(果子狸)来源的氨基酸,黄色表示SARS疫情早期出现的氨基酸,橙棕色表示疫情中期出现的氨基酸,红棕色表示疫情晚期出现的氨基酸。 6park.com
SARS-Urbani是SARS疫情晚期分离自美国的一个SARS病毒株; 6park.com
GD03是比Urbani更晚出现的SARS病毒株,它是2004年1月疫情再次零星出现时,分离自一散发广东患者的SARS病毒株。由图可见,它的部分氨基酸似乎出现了返祖现象。 6park.com
SARS疫情发生于2002年11月16日-2003年9月2日,高峰期为2002年11月16日-2003年7月16日。 6park.com
研究者首先用SZ16刺突蛋白的基因序列,以及SARS-Urbani刺突蛋白以外部分的基因序列,设计了一个嵌合的基因序列,而后基于嵌合的基因序列,使用反向遗传平台合成、收获了嵌合病毒icSZ16-S(基于基因序列合成病毒,这是反向遗传平台的基本功能)。实验证明,icSZ16-S不能感染Vero E6细胞(非洲绿猴肾细胞系细胞),也不能感染HAE细胞(人气道上皮细胞)。 6park.com
注:
ic:infectious cDNA,ic前缀表示使用反向遗传平台合成的有生物活性的冠状病毒。SZ16-S表示嵌合病毒icSZ16-S的S蛋白来自SZ16(骨架来自SARS),S蛋白即Spike蛋白,就是刺突蛋白。
HAE细胞:human airway epithelium cells,人气道上皮细胞,包括纤毛上皮细胞、非纤毛上皮细胞以及杯状细胞。 6park.com
接下来,研究者对icSZ16-S的一个RBD关键氨基酸进行了替换,人为制造了一个氨基酸突变K479N:
即将icSZ16-S刺突蛋白的第479氨基酸--赖氨酸K(来自SZ16),替换为SARS刺突蛋白的第479氨基酸--天冬酰胺N(亦称为天门冬酰胺)。第479氨基酸是SARS及SZ16五个RBD关键氨基酸中的第三个。
SZ16的第479氨基酸是赖氨酸K,SARS-Urbani的第479氨基酸是天冬酰胺N。
基于K479N替换后得到的基因序列,再次使用反向遗传平台,合成、收获了第二个实验室病毒:icSZ16-S 479N。相比不能感染Vero E6细胞的icSZ16-S,icSZ16-S 479N有了一定的“进步”:实验证明,icSZ16-S 479N能感染Vero E6细胞,并能在细胞中低水平地复制,衰弱地传代、传播;icSZ16-S 479N仍然不能感染HAE细胞。 6park.com
为使icSZ16-S 479N适应HAE细胞,研究者将其放到人气道上皮样本中持续培养,并按一定的策略反复进行传代和优化筛选。 6park.com
培养、传代、筛选第8天,得到了第三个实验室病毒icSZ16-S K479N D8。相比icSZ16-S K479N,D8在人气道上皮组织中发生了一个适应性变异Y442F:刺突蛋白第442氨基酸由酪氨酸Y变异为苯丙氨酸F; 6park.com
培养、传代、筛选第22天,得到了第四个实验室病毒icSZ16-S K479N D22。D22在Y442F变异的基础上,又发生了另一个适应性变异L472F:刺突蛋白第472氨基酸由亮氨酸L变异为苯丙氨酸F。 6park.com
SARS、SZ16刺突蛋白的第442氨基酸就是它们的第一个RBD关键氨基酸,第472氨基酸就是它们的第二个RBD关键氨基酸。也就是说,人为替换第479氨基酸(第三个RBD关键氨基酸)改造出的icSZ16-S 479N,在人气道上皮环境中,先后发生了另外二个关键氨基酸的适应性突变,变异出两种新病毒。 6park.com
相关病毒关键氨基酸对照表,表中展示了K479N替换、Y442F变异、L472F变异所涉及的关键氨基酸
有一个小小的巧合,新冠病毒、WIV1病毒、icSZ16-S K479N D22病毒的第二个RBD关键氨基酸都是苯丙氨酸F。 6park.com
S蛋白氨基酸序列长度为1269、1273的新冠、WIV1、SARS、D22五病毒关键氨基酸对照表
能感染人气道上皮(HAE)细胞的病毒已经产生了。 6park.com
实验证明:
1)icSZ16-S K479N D22能有效感染HAE细胞、Vero E6细胞、DBT-hACE2细胞,并有效复制,但它在三种细胞中的复制能力或多或少弱于icSARS(使用反向遗传平台合成的SARS流行毒株Urbani的克隆毒株);
2)icSZ16-S K479N D8也能感染上述三种细胞,但它在这些细胞中的复制能力或多或少弱于D22;
3)icSZ16-S K479N在HAE细胞和DBT-hACE2中的复制能力低下,复制滴度与D22、D8相差几个数量级;
4)icSARS、icSZ16-S K479N、icSZ16-S K479N D8、icSZ16-S K479N D22都不能感染未转基因的普通DBT细胞。 6park.com
稍后提供的四病毒对四细胞的感染实验数据图将更形象、具体地展示以上实验结果。 6park.com
注:
DBT-hACE2是论文研究者设计、制造了一种表达hACE2的转基因小鼠DBT细胞,其细胞的跨膜糖蛋白--ACE2受体被转基因为hACE2。
DBT:Delayed Brain Tumor,延迟脑肿瘤;小鼠DBT细胞,即小鼠延迟脑肿瘤细胞,或称为小鼠星形细胞瘤迟发性脑瘤细胞。 6park.com
icSARS、K479N、D8、D22对HAE、Vero E6、DBT-hACE2、普通DBT细胞的感染实验数据图。
横坐标:感染后时间,单位为小时;纵坐标:细胞培养物中的病毒滴度,单位为PFU/ml。
注:PFU,Plaque-forming unit,单位体积的病毒形成的空斑数,是代表有活性的病毒粒子浓度的单位。空斑(Plaque)是病毒诱导宿主细胞裂解形成的点状物,可通过显微镜观察。 6park.com
为研究各病毒RBD及RBD关键氨基酸与hACE2的作用、结合机制,研究者使用蛋白质结构设计、预测工具Rosetta Design生成了SZ16、icSZ16-S K479N、icSZ16-S K479N D8和icSZ16-S K479N D22等病毒的RBD结构模型,并将这些结构模型叠加到SARS Urbani RBD与hACE2相互作用的晶体结构模型上,得到了以上病毒与hACE2相互作用的晶体结构模型。 6park.com
基于RBD-hACE2相互作用的晶体结构模型,研究者极为深入地分析了各病毒442、472、479、487四个RBD关键氨基酸与hACE2的具体结合或作用情况(没有涉及最保守的第五关键氨基酸,即刺突蛋白的第491氨基酸,这几个病毒的第491氨基酸全都相同,都是酪氨酸Y),解释了不同的RBD关键氨基酸,如何导致了不同的hACE2结合能力,不同的细胞进入能力。具体分析、解读如下: 6park.com
a)SZ16的第479氨基酸残基--Lys479(赖氨酸K),似乎与hACE2的结合热点残基Lys31和His34存在静电排斥(碰撞),因而其RBD不能与hACE2良好结合,见图B。图B中lys31和His34两个hACE2残基对应的点密集团块为深褐色,表示这两个hACE2残基与附近的RBD残基存在冲突(静电排斥或碰撞)。 6park.com
b)引入点突变K479N,即将479氨基酸替换为SARS Urbani 的479氨基酸--天冬酰胺N(Asn479)后,479位点与hACE2残基的排斥力被消除,因而icSZ16-S K479N的刺突蛋白能够与hACE2结合,见图C。图C中lys31和His34两个hACE2残基对应的团块为浅绿色,表示它们与周围的RBD残基相互吻合。 6park.com
c)SARS Urbani 442、479两个RBD关键氨基酸残基分别与两个不同的hACE2残基相互作用(残基442与Lys31相互作用,残基479与His34相互作用),见图A,二对作用互不干扰,互不竞争,因而结合亲和力较强;尽管icSZ16 K479N 的442、479残基与Urbani相同,但这两个残基预计会同时与hACE2残基Asp32作用,而且,残基442预计还会同时与Lys31、Asp32这两个hACE2残基作用,见图C。这种残基作用的交叉竞争削弱了RBD与hACE2的结合亲和力,因而,icSZ16 K479N的刺突蛋白虽然能与hACE2结合,但结合能力较弱。 6park.com
d)icSZ16-S K479N、SARS Urbani唯一不同的RBD关键氨基酸是第487氨基酸,即第四个RBD关键氨基酸(参见前面的“相关病毒关键氨基酸对照表”)。前者的第487氨基酸是丝胺酸-S(Ser487),它只与一个hACE2残基(Tyr41)结合,见图C;SARS Urbani 第487氨基酸是苏胺酸-T(Thr487),它独自结合了三个hACE残基,而且没有其它RBD残基交叉竞争与这三个hACE残基的结合,见图A(图A似乎看不到与Thr487作用的三个hACE2残基?)。Urbani的487残基与hACE2的氢键强于K479N的487残基与hACE2的氢键,这是Urbani与hACE2的结合亲和力强于icSZ16-S K479N的另一个原因。 6park.com
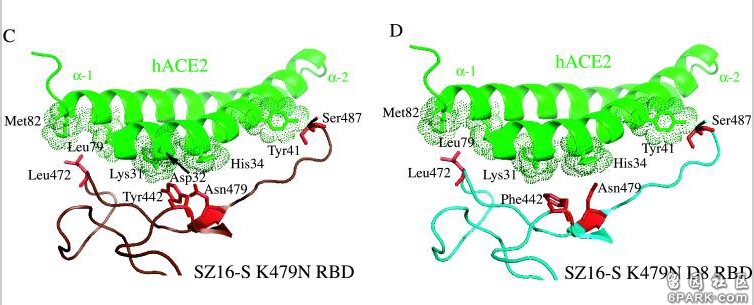
e)Rosetta Design模型预测icSZ16-S K479N D8的Y442F突变消除了K479N的442、472残基对hACE2残基的交叉竞争,D8的F442(即Phe442)、N479残基(Asn479)各自与不同的hACE2残基作用(F442结合Lys31,N479结合His34);同时,它的S487残基(Ser487)与hACE2的Tyr41残基之间的相互作用和氢键网络保持不变,见图D。这使得icSZ16-S K479N D8与hACE2的结合能力大大提高,因此,D8在HAE细胞和DBT-hACE2细胞中的生长(感染、复制)比K479N茁壮得多。 6park.com
f)Rosetta Design模型预测icSZ16-S K479N D8的L472残基(Leu472)无交叉竞争地同时结合了两个hACE2残基(Leu79、Met82),见图D;icSZ16-S K479N D22由于发生了L472F突变(亮氨酸L突变为苯丙氨酸F),预计其F472残基(Phe472)将无交叉竞争地同时结合三个hACE2残基(Leu79、Met82、Tyr83),见图E,Rosetta Design还预测F472残基将与这三个hACE2残基产生强烈的疏水相互作用,进一步加强彼此的结合。因为上述原因,L472F突变增强了RBD与hACE2的结合亲和力,所以,D22在HAE细胞和DBT-hACE2细胞中比D8更具生长优势。 6park.com
以上各图中,hACE2边缘的点密集团块表示与RBD氨基酸残基相距不超过4Å(1Å=0.1纳米)的hACE2残基,预计它们会与邻近的红色图案表示的RBD氨基酸残基发生相互作用。 6park.com
在论文前面“材料和方法”中的“SARS冠状病毒尖峰的系统发育分析和计算机建模”小节,论文仿照479替换衍生442、476突变这一模式,提出了如下RBD氨基酸替换研究模式:利用Rosetta Design web server及分子建模工具MacPyMol,对SARS病毒RBD既有氨基酸的各种替换、突变可能性进行模拟,为每个位点氨基酸的替换、改变生成十个其它位点衍生替换、改变的模型,为每个模型再生成十个次级衍生替换、改变模型,如此反复迭代,通过比较前后生成的各模型与hACE2的结合能,从中选出与hACE2结合的最佳关键氨基酸模型或最佳RBD氨基酸模型。
(这段内容在论文的后续部分似乎没有展开) 6park.com
如果我的理解没有错的话,通过上述建模和算法,Ralph S. Baric团队能得出与hACE2结合的冠状病毒最佳RBD关键氨基酸组合甚至最佳RBD氨基酸序列,所得结果可能被用于设计或辅助设计新冠病毒关键氨基酸,及新冠病毒RBD氨基酸。 6park.com
在论文Disscussion部分,研究者意犹未尽地写道:
显然,可能存在多种遗传途径来允许人畜共患病SARS冠状病毒宿主范围的扩大,确定其他接触界面点突变是否能增强人畜共患病病毒对HAE细胞(人气道上皮细胞)的感染将是一件有趣的事情。 6park.com
论文B-3也是一篇SARS相关的功能增益研究论文,它改变了冠状病毒的感染特性和宿主范围,它通过关键氨基酸的人为替换和人为创造的人气道上皮培养环境,用没有人类、灵长类感染能力的果子狸冠状病毒SZ16改造、培育出了可以感染人气道上皮细胞(HAE)和灵长类动物Vero E6细胞的可跨物种感染、传播的冠状病毒icSZ16-S K479N D8和icSZ16-S K479N D22。
D8和D22还能感染BALB/c小鼠(白变种实验室小鼠)的肺细胞,并在小鼠肺中良好生长、复制,不过,它们都不会使BALB/c小鼠产生临床症状。 6park.com
喜欢hgao朋友的这个贴子的话, 请点这里投票,“赞”助支持!
请点这里投票,“赞”助支持!


内容来自网友分享,若违规或者侵犯您的权益,请联系我们
所有跟帖: ( 主贴楼主有权删除不文明回复,拉黑不受欢迎的用户 )
hgao兄,看到了你的来信,请你不要再转发我的文章了。 - 苦难与荣耀 (27 bytes) 03/26/24
好,知道了。 (无内容) - hgao (0 bytes) 03/26/24
请hgao兄在文章中注明原文创作时间,并提供原文地址。 (无内容) - 苦难与荣耀 (0 bytes) 03/26/24
桂花酒 给 hgao 点“赞”支持3银元奖励!! (无内容) - 桂花酒 (0 bytes) 03/26/24
hgao 给 桂花酒 点“赞”支持3银元奖励!! (无内容) - hgao (0 bytes) 03/26/24
打开微信,扫一扫[Scan QR Code]
进入内容页点击屏幕右上分享按钮
进入内容页点击屏幕右上分享按钮
楼主前期社区热帖:
- 顶不住啊顶不住!蓝燕,这身材谁能顶得住嘛 04/26/24
- 原来气血才是女人的命根子!气血足、卵巢好对女人竟这么重要… 04/26/24
- 梁从诫回忆母亲《我的母亲林徽因》重新认识这位民国著名才女 04/26/24
- 多走路的人能長壽?北大最長壽的教授,一語點破養生精髓:你以為是在 04/26/24
- 服用中药之后,需要多久时间才见效?医生:一般有3个级别 04/26/24
- 澳洲移民故事:在澳洲金矿工作的武汉小伙,年薪你大胆猜一猜 04/26/24
- 听劝, 受不了这7件事, 千万别移民澳洲! 来了肯定后悔! 澳洲已经入睡了 04/26/24
- 海外友人回国的适应和不适应,春节断亲成潮流,说明了什么 04/26/24
- 6年没回国的我终于回去了!国内国外的差异越来越大 04/26/24
- 提醒:絕不能放進微波爐的10樣東西,很多人還不知道 04/26/24
- 癌症逆轉怎麼做到?哈佛醫師教你5招防癌:10年不復發 04/26/24
- 催眠音乐432Hz- Alpha Waves Heal The Whole Body and ... 04/26/24
- 血糖實測報告 那些看似健康的可怕食物 ?這些吃多注定糖尿病? 04/26/24
- 比糖更危險的一種碳水,吃了很久卻不知道 04/26/24
- 十種破壞腎臟食物排行榜,不知不覺腎功能下降的比同年齡的更快 04/26/24
- 腎臟老太快?慢性腎衰竭?十大常吃護腎食物搶救你的腎功能 04/26/24
- 外蒙古是如何被丟掉的,誰是千古罪人? 一口氣看完蒙古獨立全過程 04/26/24
- 育空淘金第二季2:淘金小白第一年淘金就挖到14公斤重的黄金,二代 04/26/24
- 育空淘金客S1:四队淘金小白怀揣着淘金梦来到育空淘金,看他们谁能发大财谁赔 04/26/24
- 警惕男人婚前承诺!年轻夫妻婚前老公答应生完小孩不用带 婚后却大变样 04/26/24
>>>>查看更多楼主社区动态...
