在我们所有人接种COVID-19疫苗之前,需要了解的事情
COVID-19已经颠覆了我们的生活,我们都听说,除非有SARS-CoV-2疫苗,否则就不会恢复到“完全正常”的状态。SARS-CoV-2是一种导致大流行的冠状病毒。但是这需要多长时间?在此过程中需要采取什么步骤?现在在什么阶段了?让我们仔细看看。
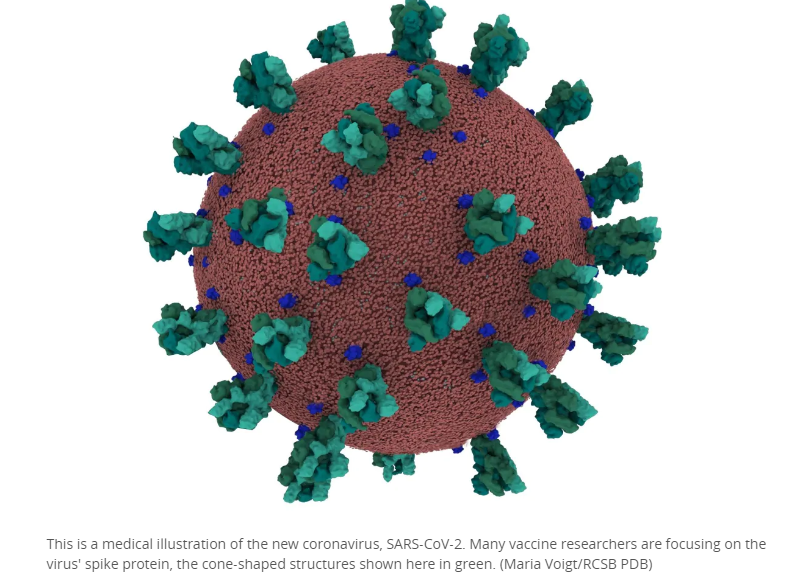
研发出针对冠状病毒的疫苗需要多长时间?当世界卫生组织在二月份首次命名该疾病时,它说第一种疫苗将在18个月内无法供应。从那以后,美国专家表示可能要花12到18个月,而欧洲药品管理局说,在“乐观”的情况下,疫苗可能会在大约一年内获得批准。 这比研发一种疫苗通常需要5到10年的速度要快得多。 新冠肺炎疫苗研发进展如何?[iframe]"[/iframe]好消息:它的运行速度比正常情况快得多。 首次人体疫苗试验开始于今年3月,就在该病毒和由该病毒引起的疾病COVID-19被发现后两个月。2003年SARS的流行,疫苗花了20个月的时间才达到可以进行人体试验的阶段,尽管该疫苗尚未开发,因为当时疫情已经结束。 截至5月15日,世界卫生组织报告称,全球有110种候选疫苗在临床前评估中,有8种正在人类1期和2期临床试验中。第一阶段的试验已被加拿大卫生部批准在哈利法克斯进行。 科学家是如何找到候选疫苗的?疫苗的工作原理是将您的免疫系统引入一个细菌或细菌的一部分,以便其识别并学习如何战胜它。针对新冠状病毒的策略包括: *一种虚弱但“活”的病毒。*一种死亡或灭活的病毒。*病毒的可识别成分或片段,例如蛋白质或糖。*基因工程RNA或DNA –这是一种针对这种冠状病毒的新方法。在大多数情况下,它以基因物质为靶标,指导合成S蛋白,该蛋白在表面形成冠状病毒的冠状突起,冠状病毒因此得名,并与人类细胞结合从而感染人类细胞。 在petri皮氏培养皿和试管中进行的初步实验室测试表明,一种特定的方法是否有可能成为有效的疫苗。 什么是临床前评估?不涉及人类的测试称为“临床前试验”。 一旦一种候选疫苗在实验室中显示出前景,将对动物进行测试以证明其安全有效。 世界卫生组织说这些测试用于帮助: *确保所有成分均无毒或与微量杂质反应以产生毒性作用,并且它们不会与同时接种的其他疫苗产生负作用。 *确定诱发免疫反应所需的剂量。 根据总部位于美国的Mayo Clinic的说法,动物测试通常需要三到六个月的时间。 但是,动物对诸如病毒等传染原或对疫苗的反应不一定与人类相同。这就是为什么通过临床前评估的疫苗不一定会成为疫苗。 什么是1期临床试验?一旦证明疫苗在动物身上安全有效,在人类志愿者身上进行的第一阶段临床试验主要是为了测试安全性。 他们通常涉及10到100个健康的成年人,即使他们不是目标年龄段。据美国疾病控制中心称,它们旨在找出: *疫苗安全吗?*它有效吗?*有严重的副作用吗?*剂量的多少与副作用有何关系? 在哈利法克斯进行的第1期冠状病毒疫苗试验始于18至55岁之间的“非常健康的志愿者”。如果早期试验证明疫苗是安全,则将添加65岁以上的志愿者。 通常对志愿者进行6到12个月的监测,但是如果疫苗看起来安全的话,则可以在阶段1完成之前开始阶段2的试验。这就是一些冠状病毒疫苗试验的情况,这些试验在成功进行了第一个阶段的试验几周后才开始第二阶段。
[iframe]"[/iframe]什么是2期临床试验?更大规模的二期试验涉及数百名健康志愿者,这次是针对疫苗的人群。现阶段的关键问题是: *最常见的短期副作用是什么*志愿者的免疫系统如何反应?*疫苗的最佳剂量是多少?何时应接种? 哈利法克斯Dalhousie大学加拿大疫苗学中心主任斯科特·哈尔珀林(Scott Halperin)表示,加拿大正在对该疫苗进行2期试验的时间将为6个月,该实验室正在加拿大进行首次临床试验。什么是3期临床试验?这一阶段通常会招募更多的志愿者(多达30,000人),他们来自易感染该疾病的人群,其中包括所有年龄段的COVID-19患者。此时的关键问题是: *在可能使用该疫苗的患者类型中,该疫苗是否能有效预防疾病?*剂量正确吗?*疫苗安全吗?*最常见的副作用是什么?*某些人不应该接种疫苗有什么副作用或原因吗? 第三阶段可以持续数年。之后,疫苗如何获得批准?在加拿大,制造商通过向加拿大卫生部生物和放射性药物管理局提交新药申请来获得批准。它需要包括: *科学和临床证据表明该疫苗是安全,有效和高质量的。*有关疫苗生产设施,生产方法和质量控制的信息。 加拿大卫生部对数据进行评估,以验证: *疫苗是安全的。*有效的。*收益大于风险。 一旦使用了疫苗,它还将审查安全监测程序。 如果疫苗符合要求,则会颁发药物识别号(DIN)和符合性声明(NOC),并授权在加拿大销售。 但是,即便如此,专家也警告说,在像COVID-19这样的全球性大流行的情况下,制造和向整个人口分配足够的药品仍可能会面临挑战。 紧急情况下可以在加拿大分发未经批准的疫苗吗?可以,在大流行等突发公共卫生事件中,加拿大卫生部可以对加拿大未批准的疫苗签发特殊授权。例如,2009年,加拿大卫生部根据欧洲的临床试验数据,使用临时命令批准了H1N1疫苗,尽管该临床试验仅在加拿大同一周才开始。 一量疫苗获得批准后,研究结束了吗?不会。疫苗在使用后需要进行监测,部分原因是一些副作用很少发生,以至于它们只能在非常大的人群中才能被发现,比任何临床试验都要多。 要求卫生保健提供者向当地卫生部门报告不良反应,制造商必须在15天内向加拿大卫生部和国际卫生组织报告所有严重不良反应。公众也可以自愿向加拿大卫生部报告不良反应。许多疫苗还具有正式的正在进行的“第4阶段”研究,该研究在疫苗被批准并使用后会继续进行。 为了响应安全报告或其他新信息,加拿大卫生部还可以命令制造商评估其产品的风险和收益,或在任何时候对其安全性和有效性进行进一步的测试和研究。
ref.:
https://www.cbc.ca/news/health/vaccine-clinical-trials-1.5580436
喜欢糯米Tse朋友的这个贴子的话, 请点这里投票,“赞”助支持!
请点这里投票,“赞”助支持!


内容来自网友分享,若违规或者侵犯您的权益,请联系我们
所有跟帖: ( 主贴楼主有权删除不文明回复,拉黑不受欢迎的用户 )
东海独钓叟 给 糯米Tse 点“赞”支持3银元奖励!! (无内容) - 东海独钓叟 (0 bytes) 05/27/20
打开微信,扫一扫[Scan QR Code]
进入内容页点击屏幕右上分享按钮

进入内容页点击屏幕右上分享按钮
楼主前期社区热帖:
- 【迎新】家附近新开了一间中国超市 12/12/21
- 【金秋十月】?万圣节前夕做南瓜灯+烤南瓜子 10/30/21
- 【金秋十月】秋天,名正言顺贴秋膘 10/18/21
- 【金秋十月】?漫步在枫叶国街区和郊野河边 10/14/21
- ?赏花+烤串,让人留恋的夏日! 06/19/21
- ?家中球兰盛开,美翻了!网友却说DIY花架更美 05/08/21
- ?三个同事对接种疫苗的反应和感受 04/25/21
- 自制广式腊肠与麻辣香肠?不受天气限制☃️ 02/19/21
- 【家居原创】广式腊肠卷? 01/08/21
- 【快乐】?️蒜泥白肉~香辣鲜爽 米饭杀手? 12/31/20
- 【巴蜀】?自制重庆小面,麻辣鲜香,开胃爽口? 12/10/20
- 【迎新】葱花蛤蜊盒子?酥皮鲜肉月饼和水晶角 12/06/20
- ?早起“三不干”,睡前“三不要”,长寿慢慢靠近你! 11/23/20
- 警惕!?手机千万不能这样充电!小哥差点把床炸?了 11/23/20
- 加国科学家突破糖尿病重大难关 或将永久治愈 11/23/20
- 加拿大又紧急召回9款超市热销鸡蛋?含致病细菌 11/23/20
- 美国30岁确诊孕妇?昏迷20天 醒来发现已诞下小男婴 11/23/20
- 泪目! 5岁男孩因新冠惨失双亲 生日前 一大群陌生人为他做了件事 11/22/20
- 恐怖!登机前全阴性 一落地7人确诊! 18小时病毒肆虐全机 阴转阳只要一瞬间 11/22/20
- “黑五”海淘包裹能否放心收?专家:不排除携带新冠病毒的可能 11/22/20
>>>>查看更多楼主社区动态...